
martes, 14 de junio de 2011
ejemplo numero 4: Anomalías de configuración electrónica
Al desarrollar la configuración electrónica, encontramos una serie de excepciones. Es más estable llenar dos medios orbitales que completar uno y dejar el otro a uno o dos electrones de estar compeltado a la mitad. Así, los metales del grupo 6 en vez de tener los orbitales externos s completos y el orbital d a un electrón de estar semi-completo, donarán un electrón del orbital s al orbital d, quedando ambos completos a la mitad: s1d5en vez de s2d4. Igualmente, es más estable rellenar los orbitales d completamente, por lo que los elementos del grupo 11 tenderán a adoptar la configuración s1d10 en vez de s2d9. Ejemplos de estas anomalías son:
Antisarrus (Antiserruchos)
Se presenta en elementos de los grupos VIB y IB
Ejemplo:
Grupo VIB:
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 : es incorrecto .
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d5 : es correcto
Grupo IB:'.i.'
29Cu: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d9 : es incorrecto.
29Cu: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10 : es correcto.
ejemplo numero 3: regla de octeto
Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de espín +1/2 y otro de espín -1/2) Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece que el nivel electrónico se completa con 8 electrones, excepto el Hidrógeno, que se completa con 2 electrones. Entonces el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógenos (en el caso del agua, por ejemplo), que cada uno necesita 1 electrón (el cual recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno. De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima, cercana al 91%. Ejemplo de ello: 10Ne: 1s2, 2s2, 2p6 regla del octeto: 11Na:(Ne)10, 1s2, 2s2, 2p6, 3s1
[editar]
ejemplo numero 2:Regla de exclusión de Pauli
Esta regla nos dice que en un estado cuántico sólo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2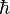 y con proyecciones
y con proyecciones  .
.
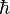 y con proyecciones
y con proyecciones  .
.También que en una orientación deben de caber dos electrones excepto cuando el número de electrones se ha acabado por lo cual el orden que debe de seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin. El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria
ejemplo numero 1: el bloque de la tabla periódica
La forma de la tabla periódica está íntimamente relacionada con la configuración electrónica de los átomos de los elementos. Por ejemplo, todos los elementos del grupo 1 tienen una configuración de [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran semejanza en sus propiedades químicas. La capa electrónica más externa se denomina "capa de valencia" y (en una primera aproximación) determina las propiedades químicas. Conviene recordar que el hecho de que las propiedades químicas eran similares para los elementos de un grupo fue descubierto hace más de un siglo, antes incluso de aparecer la idea de configuración electrónica.8 No está claro cómo explica la regla de Madelung (que más bien describe) la tabla periódica,9 ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto.
la configuración elctronica
la configuración elctronica es el modo en el cual los electrones están ordenados en un átomo.
Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecano cuántico diferente.
En un átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo; matemáticamente, sin embargo el orbital, lejos de la concepción planetaria del átomo, es la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima.
martes, 7 de junio de 2011
Svante August Arrhenius
Svante August arrehenius (*Vik, Suecia, 19 de febrero de 1859 - †Estocolmo, 2 de octubrede 1927) fue un científico (originalmente físico y más tarde químico) y profesor suecogalardonado con el Premio Nobel de Química de 1903 por su contribución al desarrollo de laquímica con sus experimentos en el campo de la disociación electrolítica.
Svante August Arrhenius nació el 19 de febrero de 1859 en la ciudad de Vik, situada en el condado de Sogn og Fjordane. Sus padres fueron Svante Gustav y Carlonia Thunberg Arrhenius. Sus allegados lo llamaban "el chueco" en su juventud, ya que debido a un accidente a temprana edad tuvo problemas para caminar hasta los 20 años. Usaba zapatos con plataforma que disimulaban dicha condición. Nunca permitió que su muy leve minusvalía a corta edad le jugara en contra en su carrera intelectual. Impartió clases de física en la Escuela Técnica Superior de esta Universidad (1891).(Uppsala, 1859 - Estocolmo, 1927) Físico y químico sueco. Perteneciente a una familia de granjeros, su padre fue administrador y agrimensor de una explotación agrícola.
Svante August Arrhenius nació el 19 de febrero de 1859 en la ciudad de Vik, situada en el condado de Sogn og Fjordane. Sus padres fueron Svante Gustav y Carlonia Thunberg Arrhenius. Sus allegados lo llamaban "el chueco" en su juventud, ya que debido a un accidente a temprana edad tuvo problemas para caminar hasta los 20 años. Usaba zapatos con plataforma que disimulaban dicha condición. Nunca permitió que su muy leve minusvalía a corta edad le jugara en contra en su carrera intelectual. Impartió clases de física en la Escuela Técnica Superior de esta Universidad (1891).(Uppsala, 1859 - Estocolmo, 1927) Físico y químico sueco. Perteneciente a una familia de granjeros, su padre fue administrador y agrimensor de una explotación agrícola.
Svante August Arrhenius
Svante August arrehenius (*Vik, Suecia, 19 de febrero de 1859 - †Estocolmo, 2 de octubrede 1927) fue un científico (originalmente físico y más tarde químico) y profesor suecogalardonado con el Premio Nobel de Química de 1903 por su contribución al desarrollo de laquímica con sus experimentos en el campo de la disociación electrolítica.
Svante August Arrhenius nació el 19 de febrero de 1859 en la ciudad de Vik, situada en el condado de Sogn og Fjordane. Sus padres fueron Svante Gustav y Carlonia Thunberg Arrhenius. Sus allegados lo llamaban "el chueco" en su juventud, ya que debido a un accidente a temprana edad tuvo problemas para caminar hasta los 20 años. Usaba zapatos con plataforma que disimulaban dicha condición. Nunca permitió que su muy leve minusvalía a corta edad le jugara en contra en su carrera intelectual. Impartió clases de física en la Escuela Técnica Superior de esta Universidad (1891).(Uppsala, 1859 - Estocolmo, 1927) Físico y químico sueco. Perteneciente a una familia de granjeros, su padre fue administrador y agrimensor de una explotación agrícola.
Svante August Arrhenius nació el 19 de febrero de 1859 en la ciudad de Vik, situada en el condado de Sogn og Fjordane. Sus padres fueron Svante Gustav y Carlonia Thunberg Arrhenius. Sus allegados lo llamaban "el chueco" en su juventud, ya que debido a un accidente a temprana edad tuvo problemas para caminar hasta los 20 años. Usaba zapatos con plataforma que disimulaban dicha condición. Nunca permitió que su muy leve minusvalía a corta edad le jugara en contra en su carrera intelectual. Impartió clases de física en la Escuela Técnica Superior de esta Universidad (1891).(Uppsala, 1859 - Estocolmo, 1927) Físico y químico sueco. Perteneciente a una familia de granjeros, su padre fue administrador y agrimensor de una explotación agrícola.
Paul Davidson Sørensen
Paul Davidson Sørensen ( * 1934 - ) es un botánico estadounidense.
Obtuvo su B.A. de la Universidad de Iowa en 1962 en francés, y se especializaría en taxonomía, logrando su M.S. en Botánica en 1966 y su Ph.D. en 1967. Y en ese año, Sorensen es designado Taxónomo Asistente de Horticultura en el Arnold Arboretum.
Ha enseñado botánica y especialmente taxonomía vegetal como asistente de varios cursos de verano, en la Universidad de Iowa, en el Servicio de Extensión en Educación de Adultos. Ha sido curador asistente en el Herbario de Iowa, entre 1964 a 1969. En los vferanos de 1965 y de 1966 asistió al Dr. T. E. Melchert en excursiones botánicas a México y a Guatemala, con especial énfasis en recolectar información deespecies silvestres de Dahlia Cav. 1791. Su tesis fue sobre la sistemática del género Dahlia.
Amedeo Avogadro
Amedeo Avogadro (Lorenzo Romano Amedeo Carlo Avogadro), Conde de Quaregna yCerreto, (*Turín, 9 de agosto de 1776 - † Turín, 9 de julio de 1856) fue un físico y químicoitaliano, profesor de Física en la universidad de Turín en 1834. Formuló la llamada Ley de Avogadro, que dice que volúmenes iguales de gases distintos bajo las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. Avanzó en el estudio y desarrollo de la teoría atómica, y en su honor se le dio el nombre al Número de Avogadro.
Hijo de un magistrado perteneciente a una antigua familia de Piamonte, el joven Amedeo sigue en primer lugar la vía paterna y obtiene la licenciatura en derecho canónico en 1796. Se inscribe luego como abogado de su ciudad natal - Turín. Pero su pasión por la Física y las Matemáticas que cultiva en solitario, lo empuja hacia estudios científicos tardíos. En 1809, obtuvo un puesto de profesor de "filosofía positiva " en el Colegio real de Vercelli.


Hijo de un magistrado perteneciente a una antigua familia de Piamonte, el joven Amedeo sigue en primer lugar la vía paterna y obtiene la licenciatura en derecho canónico en 1796. Se inscribe luego como abogado de su ciudad natal - Turín. Pero su pasión por la Física y las Matemáticas que cultiva en solitario, lo empuja hacia estudios científicos tardíos. En 1809, obtuvo un puesto de profesor de "filosofía positiva " en el Colegio real de Vercelli.

Dmitri Mendeléyev
Dmitri Ivánovic

h Mendeléyev (ruso: Дми́трий Ива́нович Менделе́ев) (8 de febrero 1834, en Tobolsk - 2 de febrero 1907, en San Petersburgo) fue un químico ruso, creador de la Tabla periódica de los elementos.
Sobre las bases del análisis espectral establecido por Bunsen y Kirchoff, se ocupó de problemas químico-físicos relacionados con el espectro de emisión de los elementos. Realizó las determinaciones de volúmenes específicos y analizó las condiciones de licuefacción de los gases, así como también el origen de los petróleos.
Su investigación principal fue la que dio origen a la enunciación de la ley periódica de los elementos, base del sistema periódico que lleva su nombre. En 1869 publicó su libroPrincipios de la química, en el que desarrollaba la teoría de la Tabla periódica de los elementos.
linus carl pauling wikipedia
Linus Carl Pauling (Portland, 28 de febrero de 1901 - 19 de agosto de 1994) fue un químicoestadounidense y una de las mentes más preclaras del siglo XX. Él mismo se llamaba cristalógrafo, biólogo molecular e investigador médico. Fue uno de los primeros químicos cuánticos, y recibió el Premio Nobel de Química en 1954, por su trabajo en el que describía la naturaleza de los enlaces químicos.
En 1939, Pauling publicó su obra más importante, The Nature of the Chemical Bond (‘la naturaleza del enlace químico’), en la cual desarrolló el concepto de hibridación de losorbitales atómicos. Tanto sus trabajos sobre los sustitutos del plasma sanguíneo (con Harvey Itano), durante la Segunda Guerra Mundial,
Pauling descubrió la estructura de la hélice alfa (la forma de enrollamiento secundario de las proteínas), lo que lo llevó a acercarse al descubrimiento de la «doble hélice» del ADN (ácido desoxirribonucleico); poco antes de que James Dewey Watson(1928–) y Francis Crick (1916-2004) hicieran el descubrimiento en 1953. De hecho, propuso una estructura en forma de triple hélice, la cual, estudiando el ADN por radiocristalografía habría podido llevar a la elaboración de un modelo en forma de doble hélice.



En 1939, Pauling publicó su obra más importante, The Nature of the Chemical Bond (‘la naturaleza del enlace químico’), en la cual desarrolló el concepto de hibridación de losorbitales atómicos. Tanto sus trabajos sobre los sustitutos del plasma sanguíneo (con Harvey Itano), durante la Segunda Guerra Mundial,
Pauling descubrió la estructura de la hélice alfa (la forma de enrollamiento secundario de las proteínas), lo que lo llevó a acercarse al descubrimiento de la «doble hélice» del ADN (ácido desoxirribonucleico); poco antes de que James Dewey Watson(1928–) y Francis Crick (1916-2004) hicieran el descubrimiento en 1953. De hecho, propuso una estructura en forma de triple hélice, la cual, estudiando el ADN por radiocristalografía habría podido llevar a la elaboración de un modelo en forma de doble hélice.

Erwin Schrödinger
Erwin Rudolf Josef Alexander Schrödinger (Erdberg, Viena, Imperio austrohúngaro, 12 de agosto de 1887 – id., 4 de enero de 1961) fue un físico austríaco, nacionalizado irlandés, que realizó importantes contribuciones en los campos de la mecánica cuántica y la termodinámica. Recibió el Premio Nobel de Física en 1933 por haber desarrollado la ecuación de Schrödinger. Tras mantener una larga correspondencia con Albert Einstein propuso el experimento mental del gato de Schrödinger que mostraba las paradojas e interrogantes a los que abocaba la física cuántica.
Schrödinger nació en Erdberg, una localidad cercana a Viena, en 1887. Era hijo de Rudolf Schrödinger,y Georgine Emilia Brenda. En 1898 entró en el Akademisches Gymnasium, una de las instituciones de enseñanza media más prestigiosas del ámbito germánico. Entre los años 1906 y 1910, Schrödinger estudió en Viena recibiendo clases de Franz Serafin Exner y de Friedrich Hasenöhrl. También realizó trabajos experimentales en colaboración con Friedrich Kohlrausch. En 1911, Schrödinger se convirtió en asistente de Exner.

Schrödinger nació en Erdberg, una localidad cercana a Viena, en 1887. Era hijo de Rudolf Schrödinger,y Georgine Emilia Brenda. En 1898 entró en el Akademisches Gymnasium, una de las instituciones de enseñanza media más prestigiosas del ámbito germánico. Entre los años 1906 y 1910, Schrödinger estudió en Viena recibiendo clases de Franz Serafin Exner y de Friedrich Hasenöhrl. También realizó trabajos experimentales en colaboración con Friedrich Kohlrausch. En 1911, Schrödinger se convirtió en asistente de Exner.
wemer heisenberg
.Werner Karl Heisenberg (Wurzburgo, Alemania, 5 de diciembre de 1901 – Múnich, 1 de febrero de 1976) fue un físico alemán. Es conocido sobre todo por formular el principio de incertidumbre, una contribución fundamental al desarrollo de la teoría cuántica. Este principio afirma que es imposible medir simultáneamente de forma precisa la posición y el momento lineal de una partícula. Heisenberg fue galardonado con el Premio Nobel de Física en 1932. El principio de incertidumbre ejerció una profunda influencia en la física y en la filosofía del siglo XX.
Werner Karl Heisenberg nació el 5 de diciembre de 1901 en Würzburgo y estudió en laUniversidad de Múnich. En 1923 fue ayudante del físico alemán Max Born en la Universidad de Gotinga, y desde 1924 a 1927 obtuvo una beca de la Fundación Rockefeller para trabajar con el físico danés Niels Bohr en la Universidad de Copenhague. En 1927 fue nombrado profesor de física teórica en la Universidad de Leipzig. Después fue profesor en las universidades de Berlín (1941-1945), Gotinga (1946-1958) y Múnich (1958-1976). En 1941 ocupó el cargo de director del Instituto Kaiser Wilhelm de Química Física, que en 1946 pasó a llamarse Instituto Max Planck de Física.

Werner Karl Heisenberg nació el 5 de diciembre de 1901 en Würzburgo y estudió en laUniversidad de Múnich. En 1923 fue ayudante del físico alemán Max Born en la Universidad de Gotinga, y desde 1924 a 1927 obtuvo una beca de la Fundación Rockefeller para trabajar con el físico danés Niels Bohr en la Universidad de Copenhague. En 1927 fue nombrado profesor de física teórica en la Universidad de Leipzig. Después fue profesor en las universidades de Berlín (1941-1945), Gotinga (1946-1958) y Múnich (1958-1976). En 1941 ocupó el cargo de director del Instituto Kaiser Wilhelm de Química Física, que en 1946 pasó a llamarse Instituto Max Planck de Física.

luis broglie
Prince Louis-Victor Pierre Raymond de Broglie (n. Dieppe, Francia, 15 de agosto de 1892- † París, Francia, 19 de marzo de 1987). Físico francés conocido a veces en castellano como Luis de Broglie.
Pertenecía a una de las familias más distinguidas de la nobleza francesa, siendo el séptimo duque de Broglie. El apellido original era italiano (Broglia de pu;os), siendo transliterado al francés en 1654. Sus parientes destacaron en actividades tales como la política, la diplomacia o la carrera militar. Cursó estudios de física teórica en la Universidad de la Sorbona, así como de historia de Francia, pues pensaba utilizarlos en su carrera diplomática. A los 18 años, después de terminar un trabajo de investigación histórica, se decidió a estudiar física, doctorándose en 1924.
Fue profesor de física teórica en la Universidad de París (1928),en el Instituto Henri Poincaré, hasta 1962. Miembro de la Academia de Ciencias (1933) y de la Academia francesa (1943), Secretario permanente de la Academia de Ciencias (1942) y consejero de la Comisión de Energía Atómica Francesa (1945).
Fue galardonado en 1929 con el Premio Nobel de Física, por su descubrimiento de la naturaleza ondulatoria del electrón, conocida como hipótesis de De Broglie. También recibió la Legión de Honor, en 1961 fue nombrado Caballero de la Gran Cruz de la Legión de Honor.

ernest Rutherford
Ernest Rutherford, barón Rutherford de Nelson, OM, PC, FRS, conocido también como Lord Rutherford (Brightwater, Nueva Zelanda, 30 de agosto de 1871 – Cambridge, Reino Unido, 19 de octubre de 1937), fue un físico y químico neozelandés. Se dedicó al estudio de las particulas radioactivas y logró clasificarlas en alfa, beta y gamma. Halló que la radiactividad iba acompañada por una desintegración de los elementos, lo que le valió ganar el Premio Nobel de Química en 1908. Se le debe un modelo atómico, con el que probó la existencia del núcleo atómico, en el que se reúne toda la carga positiva y casi toda la masadel átomo. Consiguió la primera transmutación artificial con la colaboración de su discípuloFrederick Soddy.
Durante la primera parte de su vida se consagró por completo a sus investigaciones, pasó la segunda mitad dedicado a la docencia y dirigiendo los Laboratorios Cavendish de Cambridge, en donde se descubrió el neutrón. Fue maestro de Niels Bohr y Robert Oppenheimer.
niels bhor
Niels Henrik David Böhr (Copenhague, Dinamarca; 7 de octubre de 1885 – ibídem; 18 de noviembre de 1962) fue un físico danés que realizó fundamentales contribuciones para la comprensión de la estructura del átomo y la mecánica cuántica.
Nació en Copenhague, hijo de Christian Bhor, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en laUniversidad de Copenhague en 1911, completó sus estudios en Mánchester teniendo como maestro a Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
dalton
- John Dalton (1766-1844), químico y físico británico.
- Sir Joseph Dalton Hooker (1817-1911) botánico y explorador británico.
- Los Hermanos Dalton fueron unos ladrones del Oeste de EE. UU.
- Grattan (1861-1892), Bob (1869-1892), y Emmett (1871-1937).
- También hay unos Hermanos Dalton (Joe, William, Jack y Averell) que son personajes ficticios de las historietas y dibujos animados de Lucky Luke (concebidos por Morris y René Goscinny).
- Roque Dalton (1935-1975), poeta salvadoreño.
- Timothy Dalton (1946–), actor británico.
enlace quimico
Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la electrodinámica cuántica. Sin embargo, en la práctica, los químicos suelen apoyarse en la mecánica cuántica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su descripción del enlace químico. En general, el enlace químico fuerte está asociado con la compartición o transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos -o sea la mayor parte del ambiente físico que nos rodea- está unido por enlaces químicos, que determinan la estructura de la materia.
Suscribirse a:
Entradas (Atom)



